烟台黄渤海新区生物医药产业捷报频传,荣昌生物全球首创的自身免疫新药“泰爱®”上市申请获受理,有望从源头阻断IgA肾病进展;先声药业自主研发的抗癌新药“恩泽舒®”正式获批,为卵巢癌患者提供了新的生命希望。两款重磅新药的突破,不仅标志着我国在重大疾病领域取得了源头创新的成果,更展现了“新区药”在生物医药领域的卓越研发实力与蓬勃生机。
荣昌生物泰爱®上市纳入优先审评
10月11日,荣昌生物自主研发的全球首创BLyS/APRIL双靶点融合蛋白创新药泰它西普(商品名:泰爱®)用于治疗原发性免疫球蛋白A(IgA)肾病的上市申请,已获国家药品监督管理局药品审评中心受理,并纳入优先审评程序。泰它西普成为IgA肾病领域首个申报上市的国产原研新药,申报的剂型为泰它西普注射液(预充式注射器装),将为患者提供更加便捷的给药方式。

▲10月11日,泰它西普IgA肾病适应症被CDE纳入优先审评。
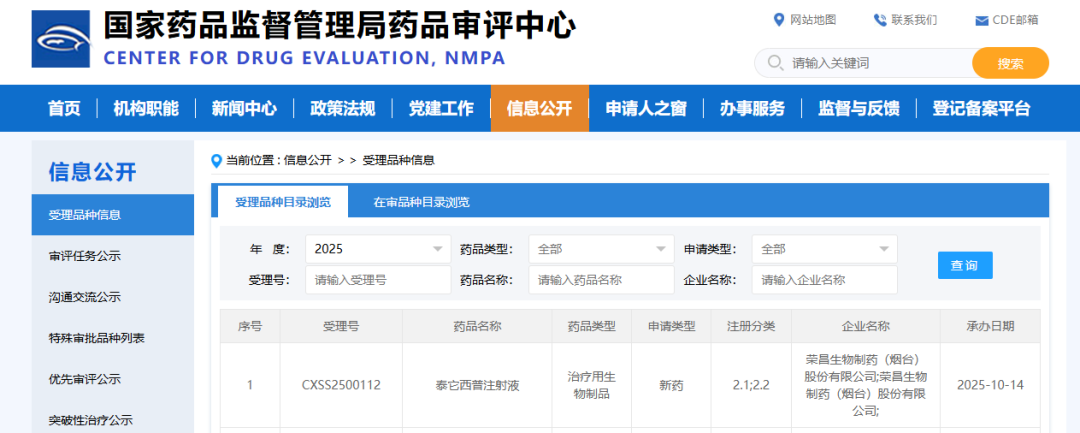
▲10月14日,泰它西普IgA肾病适应症上市申请获CDE受理。
据悉,此次申报基于泰它西普治疗IgA肾病Ⅲ期临床研究A阶段的积极结果。该研究是一项多中心、随机、双盲、安慰剂对照Ⅲ期临床试验,纳入了318例接受标准治疗的成人IgA肾病患者,泰它西普的使用剂量为240mg,皮下注射,每周1次,该研究分为A、B两个阶段,其中A阶段通过评估患者接受泰它西普/安慰剂给药39周治疗前后24小时尿蛋白肌酐比值较基线的变化,验证泰它西普在减少蛋白尿方面的有效性和安全性。
IgA肾病是全球范围内最常见的原发性肾小球疾病之一。根据弗若斯特沙利文测算,全球IgA肾病患者将于2030年达到1016万人,其中我国237万人。我国IgA肾病患者约占全部肾活检病例的54.3%,其中30%—40%的患者会进展为终末期肾病,只能依赖肾移植或透析维持生命,严重影响患者生存质量,甚至危及生命。该疾病现有治疗手段非常有限,存在巨大未满足的临床需求。

泰它西普是目前唯一可同时抑制B淋巴细胞刺激因子和增殖诱导配体的药物,而这两种细胞因子在IgA肾病患者中的水平显著高于正常人群,是疾病发生的关键驱动因素。泰它西普通过阻断BLyS和APRIL双重通道,进而抑制B细胞活化,从源头阻止致病性IgA产生,进一步阻止体液免疫反应引起的肾脏损伤,从发病上游阻断疾病的发生发展,达到治疗IgA肾病的目的。
先声药业旗下恩泽舒®获批上市
另一款已获批上市创新药,是由先声药业集团旗下子公司先声再明开发的新一代抗肿瘤血管生成(抗VEGF抗体)一类生物新药恩泽舒®(注射用苏维西塔单抗)。该药获批适应症为联合紫杉醇、多柔比星脂质体或拓扑替康用于铂耐药后接受过不超过1种系统治疗的成人复发性卵巢癌、输卵管癌或原发性腹膜癌的治疗。

据悉,恩泽舒®是我国首个取得铂耐药卵巢癌全人群适应症的靶向药,打破了该领域既往治疗选择有限的困局。恩泽舒®是一种重组人源化抗VEGF单克隆抗体,通过精准阻断VEGF与受体结合,抑制肿瘤血管生成,从而达到抗肿瘤效果。恩泽舒®独特的分子设计具有差异化的VEGF结合表位,与同类抗VEGF单抗相比,其对VEGF与其受体(VEGFR2)结合的抑制能力更强,在临床前模型中显示出更强的血管内皮细胞增殖抑制作用与肿瘤抑制能力。
恩泽舒®由先声再明与Pyxis Oncology联合开发。先声再明完成了恩泽舒®临床前和临床研究,基于先声再明自有技术平台完成细胞株筛选和工艺开发以及临床样品生产,获批后将由先声再明南京江北新区抗体工厂开展商业化生产。

“恩泽舒®的开发与获批是先声再明‘为患者而生’企业理念的重要体现。其临床获益不受前线VEGF或PARP抑制剂治疗限制,与各类化疗药物联用均有效,为卵巢癌患者提供全程守护。我们将加速推进商业化,让中国患者早日获益。”先声再明董事长兼CEO唐任宏博士表示。
恩泽舒®是先声药业创新管线中继科唯可®(盐酸达利雷生片)之后获批的第二款创新产品。受益于先声药业集团近年来持续高强度的研发投入,公司已实现上市创新药数量10款,其中近5年来获批8款,公司创新转型初见成效。2024年先声创新药收入占比已超74%,随着创新产品陆续上市,创新药业务占比将进一步巩固扩大。
编审:李蕾
法律支持单位:山东助商律师事务所




 鲁公网安备37061302000010号
鲁公网安备37061302000010号